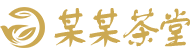这篇文献中,研究人员成功开发了 XMU-MP-9 双功能化合物,从而促进多种 K-RAS 突变体的泛素化和降解,并显著抑制携带 K-RAS 突变细胞的增殖和肿瘤发展,其利用 Monolith 分子互作平成关键验证,实现 KRAS 靶向降解机制重大突破,为抗癌药物开发开辟全新路径!
厦门大学医学院生命科学学院邓贤明/王洪睿教授团队基于之前研究中发现的 NEDD4-1 是野生型 RAS 蛋白的 E3 蛋白酶这一成果,开发了一种名为 XMU-MP-9 的化合物,能够与 NEDD4-1 的 C2 结构域和 K-RAS 的变构位点结合,增强 NEDD4-1 和 K-RAS 的相互作用,并诱导 NEDD4-1/K-RAS 复合物的构象变化,从而允许 NEDD4-1 作用于 K-RAS 的 K128 位点进行泛素化,成功提出了一种有效降解 K-RAS 突变体以防止肿瘤发展的方法。
KRAS 突变体表面光滑,传统技术难以捕捉其与小分子的结合动态。以往开发抑制剂常常需要通过耗时耗力的晶体结构解析或功能验证,而这次他们利用 Monolith 检测平台,凭借其明显优势,可轻松攻克此类分子互作中的三大痛点,提升检测效率。
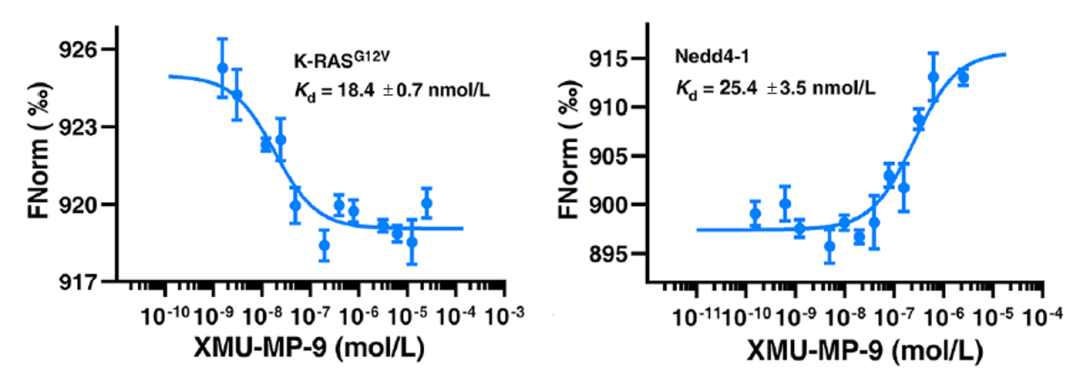
直接在溶液中检测,使蛋白保持天然构象,从而得到真实可靠的数据结果。尤其是对于三元互作或多元互作,直接将互作分子混合孵育后即可开始检测,从而成功得到在 XMU-MP-9 存在下,NEDD4-1 与 KRAS 结合亲和力呈剂量依赖性增强(图2),首次证明小分子可能促使 NEDD4-1/K-RAS G12V 复合物发生构象变化,重塑蛋白互作网络。
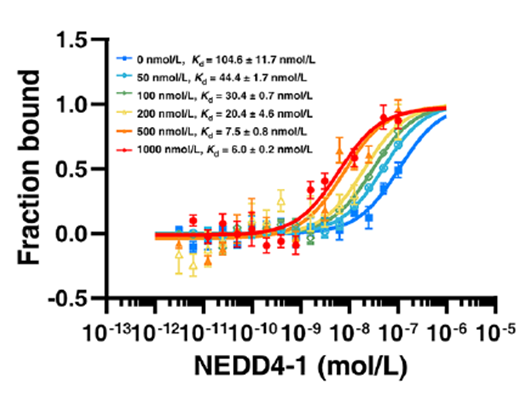
可最大程度节省宝贵的样品,降低成本。在影响结合蛋白关键位点研究中,可检测不同位点突变对结合的影响(图3)。
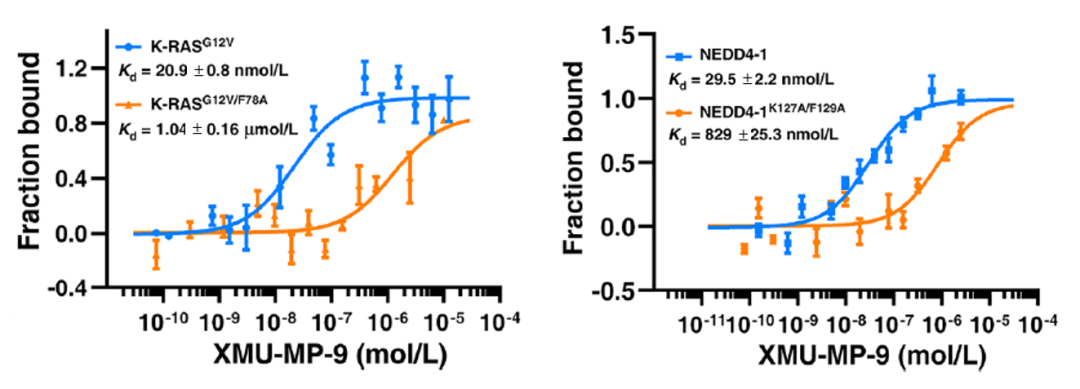
利用 Monolith 分子互作平台进行靶向降解机制研究,无需固定,直接在溶液中进行检测,尤其在三元互作和多元互作实验中,简单的混合孵育即可开始测定,仅需 10 分钟即可得到亲和力结果,省时高效,只需超微量样品就可以完成检测,降低实验成本,成功助力降解剂的研究,为抗癌药物的开发提供了极具前景的验证策略。